生命医科学科/生命医科学専攻
佐藤 政充准教授
Sato Masamitsu
| 略歴 | 2001年、東京大学大学院理学系研究科生物化学専攻 修了。博士(理学)。2002年 英国がん研究所ロンドン研究所 ポスドク研究員、2006年 東京大学助教(2009-2012年 JSTさきがけ研究員を兼任)を経て、2013年4月から現職。2012年、文部科学大臣表彰・若手科学者賞を受賞。 |
|---|---|
| 主な担当科目 | 解剖・組織学実習/生理学B/分子細胞生物学B/遺伝医学/細胞骨格制御学/細胞骨格制御学特論 |
減数分裂における微小管の役目を解明
今年、角井康貢氏(東京大学大学院理学系研究科)、登田 隆先生(Cancer Research UK)らとの共同研究により、「配偶子を作るための分裂(減数分裂)における、微小管の役目」が突き止められました。微小管は同じく細胞小器官である中心体でつくられます。チューブリンというタンパク質が重合した細長い構造体で、細胞の形を維持したり、動きを制御したりします。また、細胞分裂の際に、染色体の中央(セントロメア)にある動原体をつかまえて両極に引っ張ることで、染色体を2等分する機能を果たします。
減数分裂では通常の細胞分裂とは異なり、両親から受け継いだ遺伝子が部分的に組み換えられます。このとき細胞内では、動原体ではなく「染色体の端(テロメア)」が中心体によって束ねられ(ブーケ構造)、ブラブラと揺すられるような現象がみられます(1994年、情報通信研究所の近重らによって発見)。両親由来の染色体中の同じ部位を揃えて並べ、組み換えやすくするためだと考えられています。実は、この現象には大きなリスクが伴います。普通の細胞分裂では、中心体及びそこでつくられる微小管と動原体は極めて近い位置に存在します。ところが、減数分裂ではブーケ構造をとる際に、動原体が中心体から遠く離れてしまい、結果として微小管に捉えられにくくなってしまうのです。うまく捉えられないと染色体が正しく分配されず、染色体異常を引き起こす原因になります。
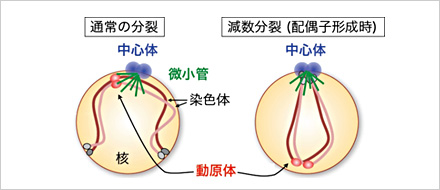
図1 通常の細胞分裂(a)と減数分裂(b)の細胞内模式図
ブーケ構造発見からの20年来、このエラーを防ぐ何らかのしくみがあるはずだといわれてきました。私は、その鍵が微小管の動きにあるのではないかと考え、解析を進めてきました。蛍光色素を使って、微小管、核、染色体を3色に染め分け、3時間にわたる減数分裂においてその動きをライブ観察してみたところ、あっと驚く現象を目の当たりにすることになりました。染色体をブラブラと揺する現象が2時間も続いた後に、わずか5分間だけ微小管があらわれ、カメレオンの舌のように伸びたかと思った瞬間、中心体から遠く離れていた動原体を絡めとって引き寄せたのです。
この現象こそが、エラーリスクの高い減数分裂でも正確に染色体を分配するしくみだったのです。さらに私たちは、動原体が「本来は染色体には結合しないタンパク質(Alp7)」を目印に使っていることも明らかにし、7月に論文として発表しました(Y. Kakui, M. Sato, et al., “Microtubules and Alp7-Alp14 (TACC-TOG) reposition chromosomes before meiotic segregation”, nature cell biology, 15, 786-796 (2013))。
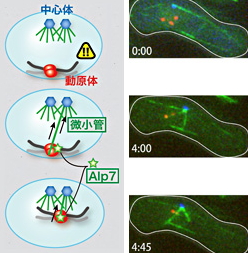
図2 左:両親由来の遺伝子を組み換えた後に、微小管が動原体を捉える様子の模式図。 右:生細胞を用いた3色イメージングシステムでの観察(微小管にはGFP(緑)、動原体にはmCherry(赤)、中心体にはCFP(青)という蛍光タンパク質を分裂酵母内に導入している)
流れにうまく乗って、微小管の領域へ
実は、確固たる信念があって微小管の研究を始めたわけではありません。私のいた大学では入学後に専門を決めることになっており、当初は物理か化学の道に進もうと思っていました。ところが、入学してみると、得意だったはずの物理や化学の最先端は私には難しく、どのような方向に発展していくのかもわかりませんでした。一方で、生物は解明したいことや実現したいことがイメージしやすく、発展を遂げつつあった遺伝子工学にも興味を覚えました。
そのため生物化学を専門として選び、卒業研究では、山本正幸先生の指導を受けました。山本研究室では分裂酵母を用いて減数分裂のしくみを研究しており、私は減数分裂に関連する遺伝子やタンパク質の解析を行いました。当時の自分は減数分裂という研究テーマをよく理解できていませんでしたが、実験をすること自体は面白かったため、そのまま大学院に進みました。
博士課程も3年生になったあるとき、Iain Mattaj先生(European Molecular Biology Laboratory)の論文に出会ったことが、私の研究の転機となりました。文献紹介の担当だったことで、たまたま目にとまった論文だったのですが、そこで紹介されていた「カエルの卵をすりつぶした抽出液に、あるタンパク質を入れると微小管が形成される」という現象の分子メカニズム解明に魅せられてしまったのです。微小管といえば、細胞分裂時にあらわれる、という程度しか理解していなかったのですが、その後は、関係しそうな論文を読みあさり、微小管の機能をもっと知りたい、と思うようになりました。
このような経緯があり、博士号取得後に、登田 隆先生(Cancer Research UK)の元で、微小管の研究を始めました。当時は英語にも海外生活にも自信がありませんでしたが、普段は何も言わなかった山本先生が「迷うくらいなら、思い切って行った方がいい」と背中を押してくれたのです。「Alp7を変異させた分裂酵母は微小管が非常に弱く、染色体をうまく分配できなくなる」ことをヒントに、その機能解明に取り組みました。蛍光タンパク質を用いて微小管や染色体などを染め分けるといった手法も、このとき確立したものです。これまでの経験から、実験は自分の出来る範囲で敷居を低くして進めることが重要だとわかっていましたので、誰もが理解でき、気軽に使える手法にすることを目指しました。

写真1 Cancer Research UK時代。留学した研究所はサポート体制の整った、研究しやすい環境でした。常に夜遅くまで実験していたわけではありませんでしたが、「ここぞ」という時期は、写真のようにプレートが高く積み上がるくらい実験しました。実験は「時間を長く」ではなく、「密度を濃く」することが大切です。
学生には、失敗を恐れず意欲をもち続けてほしい
2006年9月から助教として山本先生の元に戻り、研究室のテーマである「減数分裂」と、私が興味を持った「微小管」との両方を取り入れ、今回の成果につながった「減数分裂時の微小管の動き」を研究することにしました。そして昨年、山本先生が定年で退職され、私はこの春から先進理工学部生命医科学科に赴任し、はじめて自分のラボをもつことになりました。早稲田の学生との付き合いはまだ半年余りですが、みなさん、非常にまじめで明るく、研究の重圧を感じることもあるはずですが、負けずに頑張っています。
学生とは個別に面談し、こちらからも提案しながら、各自の研究テーマを決めています。たとえば、分裂酵母に変異誘導物質を与え、微小管が異常を起こした変異体を集めている学生もいます。
実験は失敗が日常茶飯事です。私自身の経験から、失敗を重ねて得ることは大きいと考えています。自らの頭で考え、工夫し、成功するまでがんばってもらいたいですね。前職の研究室の大学院生が私と一緒に早稲田に付いてきてくれ、学生のよきサポーターになっています。私はあまり口を出しませんが、むしろ敢えてそうすることによって彼らを育てているようにも感じています。

写真2 微小管の変異体を観察する様子
開かれたTWInsのラボで研究に邁進
研究室がある先端生命医科学センター(TWIns)の実験室は明るくカラフルで、研究室間の境界線や壁がない「オープンラボ」です。さらに、顕微鏡やDNAシーケンサーを管理する専門のスタッフがいて、学生をフォローしてくださる点も素晴らしいと思います。研究室間の交流や共同研究も多いので、私も近いうちに実現したいと目論んでいます。
今後は、引き続き、微小管の機能とそのエラーが引き起こされるメカニズムを解明していきたいと考えています。微小管が弱いと不妊や流産の一因になるとも考えられており、私自身もタンパク質レベルで微小管を強くするにはどうしたらよいか、といったことを検討しています。がんにも微小管の異常が関与していると考えられおり、研究成果の医療への応用が期待されています。いずれも容易なことではありませんが、あきらめずにコツコツ続けていきたいと思います。
聞き手・構成
西村尚子/サイエンスライター